










parallele Seiten:
|
Physik, 13 Atomphysik - bohrsches
Atommodell |
Übersicht
|

Kontinuierliches Spektrum
(Wärmestrahlung) |

Linienspektrum von
Natrium |
|
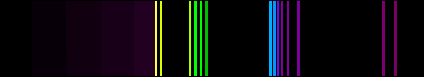
Linienspektrum von Kupfer |

Linienspektrum von
Kupfer^ |
|
Hält man ein
Metall in eine heiße Flamme, so kann man eine Flammenfärbung
beobachten die für dieses Metall typisch ist. Bunsen fand heraus,
dass diese Flammenfärbung mit einem Prisma in dünne Linien zerlegt
werden kann. Die Metallatome strahlen also keine reine
kontinuierliche Spektrum der Wärmestrahlung ab, sondern erzeugen
zusätzlich sehr helle, schmale Linien im Lichtspektrum. Dabei
leuchtet Natrium immer sehr stark gelb.
Die
beobachteten Spektrallinien sind für jedes chemische Element so
typisch, wie ein Fingerabdruck. Man kann die Elemente also mit der
Spektroskopie identifizieren. Die Farben, die ein Element in einer
Flamme abstrahlt, sind dabei identisch mit denen die das Element,
wenn es durchleuchtet wird, absorbiert. Optische Spektroskopie
ermöglicht es damit, die Zusammensetzung glühender Körper zu zu
analysieren, d.h. die enthaltenen Elemente zu bestimmen. Auf diese
Weise können Astronomen die Zusammensetzung unserer Sonne, fremder
Sterne und auch die von kosmischen Staubwolken, die Licht
absorbieren, messen. Umweltanalytiker können die Zusammensetzung von
Rauchwolken optisch vermessen, ohne eine Probe nehmen zu müssen. |
|
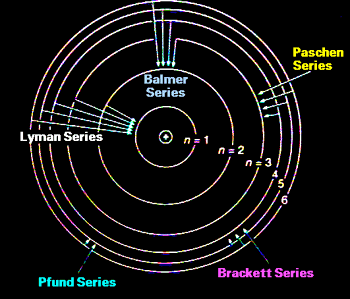 Das
bohrsche Atommodell war ein Versuch, das Vorhandensein von einzelnen
Linien in den optischen Spektren von Atomen in Analogie zum Aufbau
unseres Planetensystems zu verstehen. Schon 1885
hatte Johann Jakob Balmer (1825-1898) gezeigt, dass die Linien der
optischen Wasserstoffspektren einer einfachen Formel folgen. Diese
Formel konnte das bohrsche Modell reproduzieren. Um die erlaubten
Bahnen zu bestimmten, quantisierte Bohr zum ersten mal den
Drehimpuls der Elektronen um den Kern. Der Drehimpuls durfte also
nicht mehr beliebige, sondern nur noch bestimmte Energien annehmen.
Für diese Quantisierung benutzte er die selbe Konstante, mit der Max
Planck zuvor die Wärmestrahlung erfolgreich erklärt hatte. Das
bohrsche Atommodell war ein Versuch, das Vorhandensein von einzelnen
Linien in den optischen Spektren von Atomen in Analogie zum Aufbau
unseres Planetensystems zu verstehen. Schon 1885
hatte Johann Jakob Balmer (1825-1898) gezeigt, dass die Linien der
optischen Wasserstoffspektren einer einfachen Formel folgen. Diese
Formel konnte das bohrsche Modell reproduzieren. Um die erlaubten
Bahnen zu bestimmten, quantisierte Bohr zum ersten mal den
Drehimpuls der Elektronen um den Kern. Der Drehimpuls durfte also
nicht mehr beliebige, sondern nur noch bestimmte Energien annehmen.
Für diese Quantisierung benutzte er die selbe Konstante, mit der Max
Planck zuvor die Wärmestrahlung erfolgreich erklärt hatte. |
|
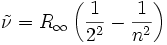 Bohrs große Leistung bestand also darin,
dass er die bekannte Balmer-Formel mit Bohrs große Leistung bestand also darin,
dass er die bekannte Balmer-Formel mit
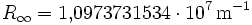 in einem einfachen Bild erklären konnte.
in einem einfachen Bild erklären konnte. |
|
 Damit
gelang es ihm, die Linien vom einfachsten Element, dem Wasserstoff,
zu berechnen. Für kompliziertere Elemente funktionierte sein Modell
dagegen nicht. Um diese zu berechnen ist die Anwendung der
Quantenmechanik notwendig. Damit
gelang es ihm, die Linien vom einfachsten Element, dem Wasserstoff,
zu berechnen. Für kompliziertere Elemente funktionierte sein Modell
dagegen nicht. Um diese zu berechnen ist die Anwendung der
Quantenmechanik notwendig.
Sieht man
etwas genauer hin, so erkennt man, dass viele der Spektrallinien
zusätzlich aufgespalten sind. Die erlaubten Elektronenbahnen müssen
sich also zusätzlich durch irgend etwas unterscheiden, das nur einen
geringen Energieunterschied ausmacht. Sommerfeld schlug darum vor,
außer Kreisbahnen auch elliptische Bahnen zuzulassen. Diese sind
etwa vergleichbar mit den Bahnen, die Meteoriten um die Sonne
einnehmen. Stark elliptische Elekronenbahnen führen das Elektron mal
dichter an den Kern und mal weiter weg. Sie haben ähnliche Energien,
wie die Kreisbahnen. |
Applet 1
Im klassischen bohrschen Atommodell stellt man sich vor, dass sich die
Elektronen auf kreisförmigen Bahnen um den Atomkern bewegen, aber
trotzdem keine Energie abstrahlen. Im Wellenbild entspricht diese
Vorstellungen einem Elektron als stehender Welle auf einer solchen
bohrschen Kreisbahn.
In diesem Applet werden diese stehenden Wellen auf Kreisbahnen
dargestellt. Die Ordnung der Bahn kann mit den Button "inc" bis
maximal N=9 erhöht und mit dem Button "dec" erniedrigt werden.
Allgemeines zu stehenden Wellen findet man unter dem Punkt "Wellen,
Stehende".
Applet 2
Bohr Model Applet Copyright 2001 The McGraw-Hill Companies, Inc.
letzte Änderung: 03.12.2005 |



















