|
Übersicht
Hier werden von mir zur Zeit
einfach nur Applets gesammelt welche zu späteren Themen gehören.

Wi
Die allgemeine Gasgleichung
Der thermische Zustand eines Gasen wird durch die Größen Volumen V, Druck p und Temperatur T beschrieben.
Man stellt fest: Für eine beliebige abgeschlossene Gasmenge (ideales Gas) ist bei Zustandsänderungen der Quotient pV/T konstant.
| Allgemeine Gasgleichung: | 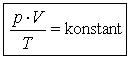 | |
|
Ist eine der drei Größen konstant, so ergeben sich folgende Spezialfälle:
1. Isotherme Zustandsänderung
(die Temperatur T bleibt konstant)
Man erhält das Gesetz von BOYLE und MARIOTTE:
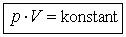 | (T konstant) |
2. Isobare Zustandsänderung
(der Druck p bleibt konstant)
Man erhält das Gesetz von GAY-LUSSAC:
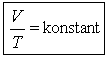 | (p konstant) |
3. Isochore Zustandsänderung
(das Volumen V bleibt konstant)
Man erhält das Gesetz von AMONTONS:
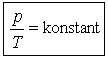 | (V konstant) |
|
Das Copyright für dieses
Applet liegt bei Klaus
Wetzstein.
Die zugehörigen Diagramme:
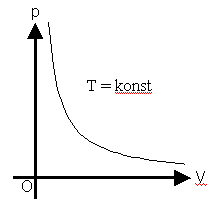
Isotherme |
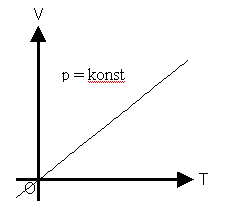
Isobare |
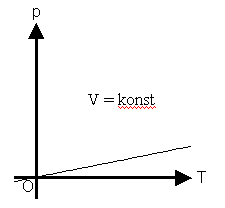
Isochore |

Erfolgt die Zustandsänderung ohne Austausch von Wärmeenergie (DW = 0), so handelt es sich um einen adiabatische Prozess.
| Die Zustandsänderung erfolgt nach folgender Gesetzmäßigkeit: | 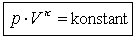 |
Der Exponent k hängt von der Art des Gases ab.
Ze
letzte Änderung: 4.6.2004 |