










untergeordnete
Seiten:
|
Physik, 13 Atom- und
Kernphysik |
Übersicht
Hier der Link zu der in dieser
Unterrichtreihe verwendeten OHP Folien:
Atome.zip (Stand 13.12.05).
Rutherford
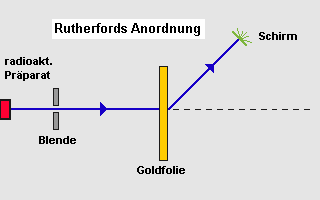 Was würde wohl passieren, wenn man eine dünne Goldfolie,
hunderte von Atomlagen stark, mit positiv geladenen Bruchstücken
aus einem radioaktiven Zerfall (Alpha-Teilchen, 2 fach positiv)
beschießen würde?
Rutherford beobachtet die "Einschläge" der Alpha-Teilchen
auf einem Szintillationsschirm, der aufblitzt, wenn ein Teilchen
auftrifft.
|
 | würden diese Teilchen an der massiven "Atommauer"
abprallen und zurückgeworfen werden?
|
 | würden sie energiereich genug sein, die Wand zu durchdringen
und kaum aus ihrer Richtung abgelenkt werden, weil die positive
Ladung gleichmäßig verteilt ist und die leichten Elektronen
kaum stören?
|
 | würde gar etwas Unerwartetes passieren? |
|
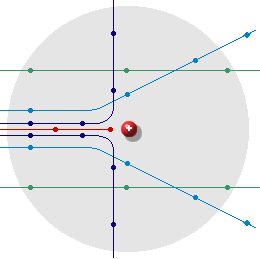 Auf
Teilchen, die sehr weit am Kern vorbeifliegen, übt der Atomkern fast
keine Kräfte aus. Sie fliegen praktisch ungehindert durch das Atom
hindurch. Auf
Teilchen, die sehr weit am Kern vorbeifliegen, übt der Atomkern fast
keine Kräfte aus. Sie fliegen praktisch ungehindert durch das Atom
hindurch.Teilchen, die näher am Kern vorbeifliegen
werden je nach Ladung von diesem mehr oder weniger stark abgestoßen
(Teilchen positiv geladen) oder angezogen (Teilchen negativ
geladen).
Sie werden aus ihrer ursprünglichen Richtung
abgelenkt, und zwar um so mehr, je näher sie dem Kern kommen.
(Streuung)
Ein positiv geladenes Teilchen auf
"Kollisionskurs" wird auf dem Weg zum Kern immer mehr
abgebremst und kehrt schließlich um. (Rückstreuung)
Je energiereicher es ist, um so näher kann es dem Kern kommen. Da
der Kern sehr klein ist, passiert das sehr selten.
|
© Grüninger,
Landesbildungsserver, 2002 Eine genauere Beschreibung erfolgt
auf der untergeordneten Seite
Rutherford.
bohrsches Atommodell
Frank Hertz
Versuch
| Das Experiment, das Franck und Hertz im Jahr 1914 durchführten,
ist eines der Schlüsselexperimente, die bei der Entwicklung der
modernen Atomphysik halfen. Es hat uns gezeigt, dass die Atome
Energien nur in bestimmten Portionen oder 'Quanten' aufnehmen und
bestätigte so die bohrschen Postulate. |
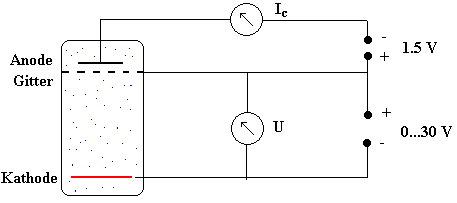 In dieser Abbildung sieht man die Umrisse einer Röhre mit der das
Experiment durchgeführt wird und die Quecksilberdampf unter
niedrigem Druck enthält. Die Glühkathode sendet Elektronen aus,
deren kinetische Energie zu Beginn praktisch 0 ist. Sie gewinnen
dadurch kinetische Energie, dass sie von einer Spannung zwischen der
Kathode und dem Gitter beschleunigt werden. |
Auf diesem Weg stoßen sie mit den Quecksilberatomen zusammen und
können dabei an Energie verlieren.
Elektronen, die eine kinetische Energie von mindestens 1,5 eV haben
wenn sie das Gitter erreichen, überwinden das Gegenfeld und gelangen zur Anode und tragen
somit zum
Anodenstrom Ic bei.
Elektronen, die beim Erreichen des Gitters weniger als 1,5 eV an
kinetischer Energie haben, können die Gegenspannung nicht
durchlaufen und tragen daher auch zum
Anodenstrom Ic nichts bei. |
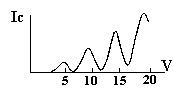 Die Stromstärke Ic zeigt mehrere
Rückgänge jeweils im Abstand von etwa 4.9 eV.
Der erste Rückgang stammt von den Elektronen, die
ihre gesamte kinetische Energie bei einem Stoß mit
einem Quecksilberatom abgegeben haben.
Der zweite Rückgang stammt von den Elektronen, die
ihre Energie bei zwei aufeinander folgenden Stößen
an zwei verschiedene Quecksilberatome abgegeben haben. |
|
Eine genauere Beschreibung erfolgt
auf der untergeordneten Seite Frank
Hertz. |

letzte Änderung: 13.12.2005 |



















